Glutatione
Glutatione
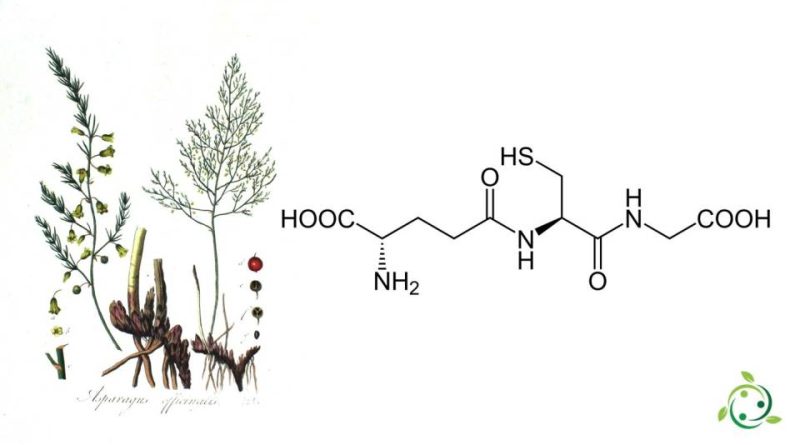
Il glutatione, il cui termine nella nomenclatura ufficiale IUPAC è: acido (2S)-2-ammino-5-[[(2R)-1-(carbossimetilammino)-1-osso- 3-solfanilpropan-2-il]ammino]-5-ossopentanoico, è un tripeptide di origine naturale con formula bruta o molecolare: C10H17N3O6S.
Il glutatione è conosciuto con l’abbreviazioni GSH ed ha il nome alternativo di: γ-L-glutammil-L-cisteinilglicina.
Il glutatione è una sostanza costituita da tre amminoacidi e cioè, nell’ordine: acido glutammico, cisteina e glicina. Questa particolare composizione chimica conferisce al glutatione un’elevata capacità di ossidarsi o ridursi, proteggendo le proteine e gli altri composti ossidabili dall’azione deleteria dei radicali liberi.
Sintesi del glutatione –
Il glutatione viene sintetizzato a partire da glutammato e cisteina, uniti da un legame peptidico atipico dall’enzima Glutammato-Cisteina Ligasi (consuma 1 ATP -> ADP + Pi) per formare il γ Glutammilcisteina. Da qui poi l’enzima Glutatione Sintetasi (consuma 1 ATP -> ADP + Pi) lega una glicina al precedente composto formando così il Glutatione.
Il glutatione rientra nella composizione di un gruppo di enzimi ad azione antiossidante, chiamati glutatione perossidasi. Molti di questi enzimi, la cui attività è legata alla presenza di selenio, catalizzano la neutralizzazione dell’acqua ossigenata (un potente radicale libero) e di altri perossidi.
Azione del glutatione –
Il glutatione ha un’azione importante sia contro i radicali liberi o molecole come perossido di idrogeno, nitriti, nitrati, benzoati e altre; inoltre svolge un’importante azione nei globuli rossi, proteggendo tali cellule da pericoli ossidativi che causerebbero l’emolisi. Elemento importante per il suo funzionamento è il NADPH. Tale molecola è un derivato della vitamina PP (acido nicotinico) e funziona da cofattore ossido-riduttivo dell’enzima glutatione reduttasi (o GSR). L’enzima rigenera il glutatione ridotto (GSH) a partire da glutatione ossidato (o GSSG) attraverso gli elettroni ceduti dal NADPH al GSSG.
Il glutatione trova impiego in medicina come antidoto diretto e “veloce” nell’avvelenamento da paracetamolo (conosciuto anche come acetaminofene). Questa molecola è un analgesico ed anti-febbrile il cui principale metabolismo avviene a livello del fegato. Quando in eccesso, il paracetamolo ossida il glutatione.
La tossicità del paracetamolo si esplica perciò in due meccanismi: con la deplezione del glutatione e con l’azione diretta del para-acetamido-chinone che provoca necrosi delle cellule epatiche.
Il glutatione trova, inoltre, impiego come tampone nei casi di avvelenamento da metalli pesanti (come mercurio, cadmio, piombo, ecc.), dato che sposta gli ioni tossici formando dei solfuri (coniugati) più facilmente eliminabili dall’organismo.
A livello umano il glutatione è solo in piccola misura biodisponibile in quanto la sua introduzione nell’organismo utilizzando fonti esterne è scarsamente efficace per incrementarne la sua concentrazione plasmatica e/o intracellulare. Alla base della sua scarsa biodisponibilità sono la natura del glutatione che, essendo un peptide, è substrato delle peptidasi e proteasi del canale alimentare, e l’assenza di un carrier specifico del glutatione a livello della membrana cellulare.
Glutatione negli alimenti –
Il glutatione è contnuto naturalmente in alcuni vegetali tra cui:
– asparagi, avocado, cavoli, cavoletti di Bruxelles, spinaci, broccoli, aglio, erba cipollina, gombo, pomodori, cetrioli, mandorle, avocado e noci.
Tuttavia, i livelli di glutatione tendono a ridursi con la conservazione e la cottura.
Per mantenere adeguati livelli di glutatione, è dunque importante consumare alimenti che forniscano i mattoni necessari ad aumentarne la sintesi in modo naturale.
Questi alimenti sono ricchi dei precursori del glutatione, come cisteina e zolfo.
Carenza di glutatione –
La carenza di glutatione aumenta la suscettibilità allo stress ossidativo, che può essere causa o concausa di molte malattie, tra cui cancro, malattie cardiache, morbo di Parkinson e Alzheimer.
I livelli di glutatione nel corpo possono essere ridotti da una serie di fattori, tra cui scarsa nutrizione, tossine ambientali e stress. Inoltre, diminuiscono con l’età.
Mantenere livelli adeguati di glutatione è dunque importante per la salute generale dell’organismo e può avere benefici in determinate condizioni patologiche caratterizzate da un aumentato stress ossidativo.
Avvertenza: le informazioni riportate non sono consigli medici e potrebbero non essere accurate. I contenuti hanno solo fine illustrativo e non sostituiscono il parere medico.