Alliina
Alliina
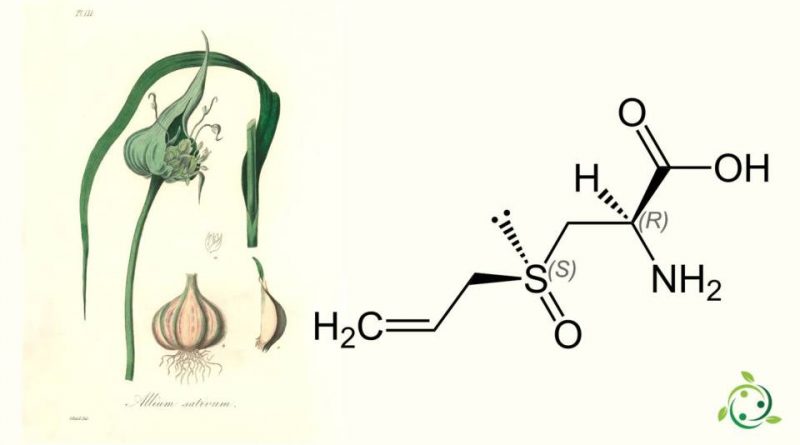
L’alliina, il cui termine nella nomenclatura ufficiale IUPAC é. S-3-(2-Propen 1-sulfinil)L-alanina.
L’ proteinogeno ha formula bruta o molecolare: C6H11NO3S ed è un amminoacido non proteinogenico ed un solfossido naturale presente, insieme a cicloalliina, isoalliina e metiina, nell’aglio fresco.
Tuttavia l’ alliina non è la sostanza che determina il forte odore che si avverte quando si schiaccia o taglia uno spicchio dal bulbo di aglio.
Il meccanismo si mette in funzione quando il bulbo risulta rotto, schiacciato, sminuzzato, ecc. in quanto l’alliina che viene rilasciata va ad interagire con l’enzima presente nei vacuoli cellulari adiacenti, ovvero l’alliinasi.
Questo enzima, a contatto con l’ alliina, da seguito, per idrolisi, di sostanze intermedie (specialmente acidi sulfenici, come l’acido allilsulfenico), i quali si autocondensano rapidamente per creare diversi tiosulfati.
L’alliina fu descritta per la prima volta dai chimici svizzeri Arthur Stoll ed Ewald Seebeck nel 1950, ed è infatti un amminoacido totalmente inodore ed insapore, almeno finché l’aglio non viene effettivamente tagliato o schiacciato.
La prima sintesi riportata, da Stoll e Seebeck nel 1951, inizia con l’alchilazione della L-cisteina con allil bromuro per formare deossialliina. L’ossidazione di questo solfuro con perossido di idrogeno fornisce entrambi i diastereomeri della L-alliina, che differiscono nell’orientamento dell’atomo di ossigeno sullo stereocentro dello zolfo.
Una via più recente è stata riportata da Koch e Keusgen nel 1998; questa consente l’ossidazione stereospecifica utilizzando condizioni simili all’epossidazione asimmetrica di Sharpless. Il catalizzatore chirale è prodotto da dietil tartrato e titanio isopropossido.
La biosintesi della alliina trae origine dall’amminoacido cisteina.
Inoltre il composto è poco stabile, e per prevenirne l’ossidazione va mantenuto a 4 °C.
Avvertenza: le informazioni riportate non sono consigli medici e potrebbero non essere accurate. I contenuti hanno solo fine illustrativo e non sostituiscono il parere medico.