Treonina
Treonina
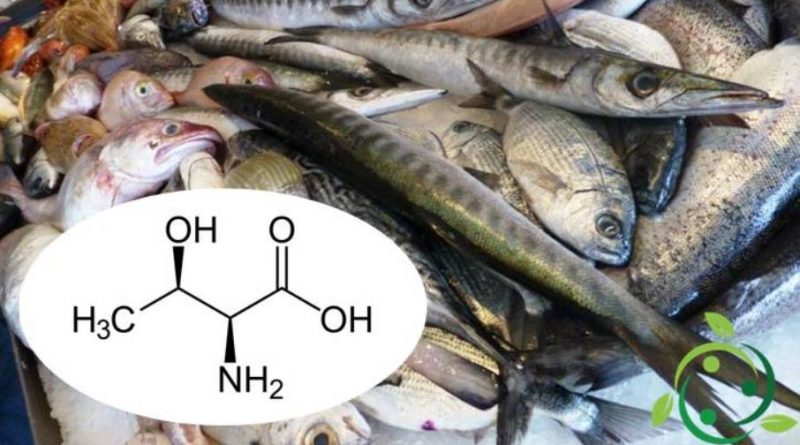
La treonina, chimicamente conosciuta come acido 2(S)-ammino-3(R)-idrossibutanoico è α-amminoacido con formula bruta o molecolare: C4H9NO.
Questo α-amminoacido è utilizzato nella biosintesi delle proteine.
La treonina è un amminoacido essenziale contenente un gruppo carbossilico, un gruppo amminico in posizione α e una catena laterale contenente un gruppo ossidrilico.
Questa molecola contiene due centri chirali ma quando si fa riferimento alla treonina si intende l’acido 2(S)-ammino-3(R)-idrossibutanoico che, a pH fisiologico, si presenta sotto forma di zwitterione.
La treonina differisce dalla serina presentando un gruppo –CH3 piuttosto che un idrogeno sul carbonio in β e dalla valina presentando gruppo –OH piuttosto che un gruppo –CH3 sul carbonio in β.
La treonina, essendo un amminoacido essenziale, nella sintesi proteica non viene sintetizzata da altri amminoacidi ma deve essere assunta con gli alimenti.
Solo nei microrganismi e nelle piante la treonina viene ottenuta a partire dall’acido aspartico.
La treonina è l’ultimo degli amminoacidi ad essere identificata e scoperta nel 1936 dal biochimico statunitense William Cumming Rose.
Questo amminoacido esplica le sue funzioni supportando il sistema immunitario nella produzione di anticorpi.
La treonina è uno degli amminoacidi di cui sono composte proteine e peptidi, sia animali che vegetali.
Le fonti alimentari di treonina sono date principalmente dalle uova, dai prodotti caseari, da carne e pesce.
Il fabbisogno giornaliero di treonina è di circa 0,95g/die (8-20mg/kg nell’adulto) e si tratta di uno degli amminoacidi che più facilmente mancano nella dieta vegana, ovvero quella totalmente priva di ingredienti di origine animale; è ad esempio l’amminoacido limitante del riso e, dopo la lisina, scarseggia anche negli altri cereali di largo consumo.
La carenza lieve di treonina può originare forte irritabilità psicologica e disturbi della personalità; quella severa è difficilmente definibile ma di certo molto grave. L’eccesso di treonina, invece, è correlato ad un’impennata dell’azotemia, con relative compromissioni degli organi deputati al metabolismo e allo smaltimento dell’eccesso nel lungo termine.
Dal punto di vista metabolico, la treonina, oltre a costituire una molecola plastica dei polimeri proteici (destinati alla costituzione dei tessuti, di certi ormoni, di neurotrasmettitori, di canali cellulari, di immunoglobuline ecc.), funge da carrier (trasportatore) per i gruppi fosfato (PO43-) delle fosfoproteine (ad es., le caseine del latte), grazie alla capacità di riceverli in corrispondenza della catena laterale.
Tale processo consente di trasformare le caratteristiche chimico-fisiche del polimero in oggetto ed avviene per mezzo di un enzima catalizzatore protein-chinasi. La fosforilazione più nota è quella del trasferimento del gruppo fosfato dall’ATP (Adenosin Tri Fosfato) o dalla GTP (Guanosin Tri Fosfato) alla treonina o alla serina o alla tirosina.
La treonina, inoltre, partecipa a moltissime reazioni di sintesi o metabolizzazione; ad esempio, è coinvolta nel metabolismo di creatina, altri amminoacidi, cobalamina (vit. B12), neurotrasmettitori (adrenalina e colina) ecc.
Per di più la treonina ha una importante interazione col selenio, un minerale antiossidante, ed un ruolo fondamentale nei processi metabolici epatici delle molecole di rifiuto.
Questo amminoacido riveste infine un ruolo importante per chi fa attività sportiva. In queste persone come la leucina, la valina e la lisina, anche la treonina è più soggetta ad ossidazione energetica rispetto agli altri amminoacidi, ragion per cui è logico pensare che possa richiedere un introito superiore nello sportivo.
La treonina viene commercializzata anche sottoforma di integratori, principalmente per la sua potenziale capacità di favorire le funzioni digestive, la salute mentale e la sintesi di collagene ed elastina.
Avvertenza: le informazioni riportate non sono consigli medici e potrebbero non essere accurate. I contenuti hanno solo fine illustrativo e non sostituiscono il parere medico.