Acido lattico
Acido lattico
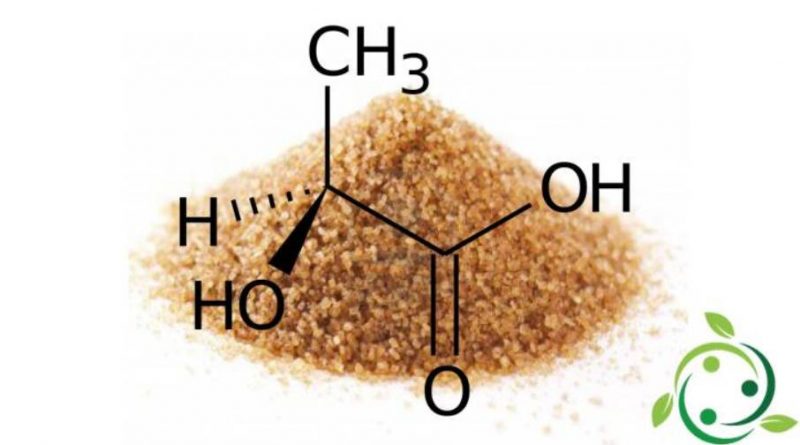
L’acido lattico, il cui termine nella nomenclatura ufficiale IUPAC è: acido 2-idrossipropanoico è un acido carbossilico avente formula bruta o molecolare: C3H6O3.
La molecola dell’acido lattico è chirale per cui esistono due enantiomeri. L’enantiomero prodotto dai sistemi metabolici in natura è l’acido S-(+)-lattico o acido L-(+)-lattico.
Dalla deprotonazione dell’acido lattico si ottiene lo ione lattato.
Per via della sua costante di ionizzazione a pH fisiologico questo composto si trova quasi interamente sotto forma di lattato.
Nei sistemi cellulari, inoltre, a pH fisiologico, l’acido lattico è dissociato per oltre il 99% in ione lattato (La-) e ione idrogeno (H+).
Sia l’acido che i suoi sali alcalini sono solubili in acqua.
In condizione di metabolismo anaerobico si producono ioni H+ e ioni lattato: in queste condizioni la presenza degli ioni H+ interferisce col pH cellulare delle fibre muscolari ed il loro accumulo è all’origine della cosiddetta fatica muscolare.
In condizioni di abbassamento del pH, comunque, il corpo umano reagisce attraverso l’immissione del lattato nel circolo ematico, provvedendo così alla sua riconversione in glucosio grazie all’attività del fegato (ciclo di Cori).
A livello cardiaco invece si ha la metabolizzazione del lattato a scopo energetico, così come succede nei reni e nel cervello.
In condizione però di estrema di fatica, che vanno oltre alla capacità metabolica di questi organi a riconvertirlo, il pH muscolare si abbassa sino a che la contrazione muscolare viene del tutto impedita, raggiungendo un vero e proprio spasmo doloroso.
Cessata comunque l’attività, per via del ciclo metabolico, il lattato nel circolo ematico viene rapidamente eliminato da esso (si nota una netta riduzione già entro 60 secondi) mentre viene smaltito nel resto del corpo nel giro di 2 o 3 ore dal termine dell’attività fisica.
La presenza di acido lattico rappresenta un forte stimolo per la produzione degli ormoni anabolici come la somatotropina ed il testosterone. Per questo motivo esercizi fisici ad elevata intensità, intervallati da pause non troppo lunghe, massimizzano il guadagno di massa muscolare.
Sempre in natura l’acido lattico viene prodotto dalla fermentazione operata dai batteri lattici, come Streptococcus, Pediococcus e Lactobacillus, su melasse, barbabietola o canna da zucchero. L’acido lattico si forma per riduzione batterica dell’acido piruvico (CH3COCOOH), che proviene dai materiali di partenza vegetali, passando attraverso ad una complessa serie di reazioni enzimatiche simili a quelle che avvengono nella fermentazione alcolica.
L’acido lattico, allo stato libero, si trova anche in molte piante, dove appunto è il prodotto della fermentazione operata dai batteri lattici.
Nell’industria alimentare i sali dell’acido lattico (E325 lattato di sodio, E326 lattato di potassio, E327 lattato di calcio, E585 lattato ferroso) sono usati come additivi.
Come acidificante alimentare, l’acido lattico (E270) ha un sapore meno marcato rispetto ad altri additivi, non volatile e senza odore.
L’acido lattico viene utilizzato come conservante, acidificante, aroma, tampone di pH e antibatterico in numerose applicazioni e processi alimentari, come ad esempio la produzione di dolci, pane e pasticceria, bibite, salse, sorbetti, prodotti caseari, birra, marmellate e confetture, maionese e altri cibi elaborati, spesso in unione con altri additivi.
L’acido lattico ed i suoi sali vengono utilizzati per la conservazione di carni e pesce in quanto inibisce la crescita di colonie batteriche come ad esempio Clostridium botulinum.
Avvertenza: le informazioni riportate non sono consigli medici e potrebbero non essere accurate. I contenuti hanno solo fine illustrativo e non sostituiscono il parere medico.