Histidina
Histidina
La histidina, mejor conocida como L-histidina y abreviada con los términos H e His, es un aminoácido.
La histidina fue aislada por primera vez en 1986 por el físico alemán Albercht Kossel y Sven Hedin.
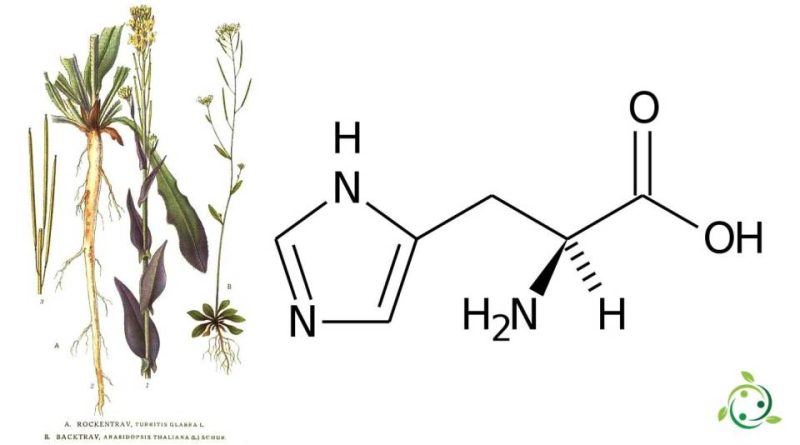
En la terminología oficial de la IUPAC es: ácido 2 (S) -amino-3- (4-imidazolil) propanoico; L-3-imidazol-4-ilalanina y tiene una fórmula bruta o molecular: C6H9N3O2.
La histidina es un aminoácido cuyo grupo lateral lleva un anillo de imidazol. Está codificado por los codones CAU y CAC, y es una molécula polar y quiral.
Este aminoácido por su particular composición se clasifica como cargado positivamente a pH fisiológico.
Su enantiómero L es uno de los 20 aminoácidos ordinarios de la bioquímica, considerado esencial en el ser humano para los niños y durante el desarrollo.
También se recuerda que la histidina es un precursor de la biosíntesis de la histamina, un agente inflamatorio vital en las respuestas inmunes.
La histidina se obtiene por hidrólisis de numerosas sustancias proteicas.
Desde el punto de vista físico se presenta en cristales incoloros, ópticamente activos, solubles en agua, insolubles en alcohol y en éter, que por descarboxilación se transforman en histamina. Puede obtenerse por síntesis de diferentes formas. En cuanto a su valor nutricional, la histidina no se considera un aminoácido esencial para hombres adultos y adolescentes, mientras que sí lo es para la primera infancia. También es esencial para la mayoría de los mamíferos.
La histidina está contenida en proporciones relativamente altas en la hemoglobina. El grupo imidazol de la histidina constituye el sitio activo de muchas enzimas: las modificaciones químicas de residuos de histidina específicos provocan de hecho su inactivación. La principal vía del catabolismo de la histidina en mamíferos y humanos pasa por su transformación en ácido glutámico, que comienza con la degradación de la histidina a ácido urocánico por la acción de la enzima histidasa.
La deficiencia hereditaria de histidinasa (la enzima que descompone la histidina) que puede transmitirse como rasgo recesivo, conduce a la acumulación en la circulación de histidina (histidinemia) con un cuadro de retraso mental y estatutario, anemia, pigmentación deficiente de la piel; también se acompaña de un aumento de la excreción del aminoácido en la orina (histidinuria). La histidinuria elevada puede ocurrir durante el embarazo (histidinuria gravidarum) y en algunas condiciones de insuficiencia hepática funcional.
Biosíntesis –
La histidina es un aminoácido esencial que no se sintetiza en el ser humano, por lo que debe introducirlo a través de la dieta o de los suplementos. La biosíntesis de histidina se ha estudiado ampliamente en procariotas como Escherichia coli. Como los animales y los microorganismos, las plantas también necesitan histidina para crecer y desarrollarse. Los microorganismos y las plantas son similares entre sí porque pueden sintetizar histidina, ambos a través del intermedio bioquímico fosforribosilpirofosfato. En general, la biosíntesis de histidina es similar en plantas y microorganismos.
Propiedad –
La histidina es un aminoácido esencial que, como se mencionó, entra en la constitución de numerosas proteínas; se obtiene por hidrólisis de las propias proteínas o sintéticamente, y se utiliza en medicina, junto con la urea, como agente cicatrizante en el tratamiento de úlceras gástricas y duodenales, llagas, heridas, etc.
Advertencia: La información que se muestra no es un consejo médico y puede no ser precisa. Los contenidos son solo para fines ilustrativos y no reemplazan el consejo médico.